[아이팜뉴스] 암유전자 패널검사(F1CDx)가 지난 1일 미국에서 FDA와 CMS에서 동시 승인되거나 공공보험 급여등재함으로써 향후 전세계 암유전자 진단 의료기기 시장에 새로운 혁신을 가져올 것으로 예고되고 있다.
미래에셋대우증권은 최근 보고서에서 이같은 사실을 지적 했는데, 암 유전자 진단 의료기기가 FDA와 CMS(건강보험공단과 유사 기관)가 Foundation Medicine(FMI US)의 암 유전자 진단기기인 ‘FoundationOne CDx’(F1CDx)에 대해 동시에 허가-승인 함에 따라 ‘인증’(의료기기)과 ‘등재’(의료보험)이 동시에 이루어져 암 진단에 새로운 전기를 마련할 조짐이다.
Foundation Medicine은 과거 애플의 CEO였던 스티브잡스의 암검진을 수행했던 업체로 ‘F1CDx’가 미국에서 의료기기로서 FDA 승인을 받은 최초이자 유일한 고형암 다중(Multiplex) 진단 기기라는 점에서 향후 암진단 의료기기 시장에 혁신을 가져올 것으로 전망된다.
‘F1CDx’는 기존 암 진단 기기들이 1번에 1개의 유전자 검사가 가능한 데 비해, NGS(차세대 유전체 검사)기법 중 유전자 패널 분석을 이용하여 한번에 324개 유전자의 변이(유전자 삽입결실, 유전자 복제수 변이, 유전자 대체 등)를 검사할 수 있음으로 해서 혁신적인 성과에 주목받고 있다.
‘F1CDx’는 특정 바이오마커를 진단하여 FDA 승인된 표적 암 치료를 수행하는 동반 진단에 이용될 수 있으며, 특히 5개 주요 암종인 비소세포 폐암 (NSCLC), 흑색 종(melanoma), 대장암(colorectal cancer), 난소암(ovarian cancer), 유방암(breast cancer) 환자를 대상으로 한 17개의 치료법(각각의 적응증에 대한 1차 요법으로 승인된 12개의 치료법 포함)을 사용하기 위한 동반진단 용도로 활용될 수 있다는 점에서 암 진단을 다각적으로 수행 할수 있어 향후 암 진단 의료기기 시장에 혁신을 일으키는 기폭제가 될 전망이다.
또한, 신약개발 업체 입장에서 표적치료제 개발을 위한 동반진단 플랫폼으로 활용될 수 있는 데 기존 Foundation Medicine의 CGP(Comprehensive Genome Profiling) 결과에 의하면, 5개 주요 암종 환자의 1/3에 해당하는 환자가 FDA 승인된 치료법과 매칭될 수 있을 것으로 기대되고 있다는 것이다.
특히 CMS의 보험급여 적용 항목 등재(NCD, National Coverage Determination) 및 관련 세부사항은 앞으로 최종적인 의견 수렴을 거쳐 내년 1분기중에는 발표될 예정이다.
이러한 사실들은 앞으로 국내에도 영향을 미쳐 의료기기산업의 규제 리스크를 완화하는 분기점으로 작용할 가능성이 있다는 점에서 주목되고 있는 것이다.
헬스케어는 규제 산업으로 새로운 의료기기의 경우 국내외를 막론하고 인증과 허가를 받아야 하기에 일반적으로 의료기기 인증을 받고, 보험 급여 적용을 위한 수가 검토를 받는 과정을 거치게 되는데, 국내의 경우 기존에 없던 새로운 의료기기의 경우 신의료기술평가를 추가적으로 더 받아야 함으로써 급여 적용까지는 절차가 까다롭고 시간도 많이 소요되고 있는 실정이다.
미국은 전 세계 헬스케어 산업의 50%를 차지하는 매우 큰 시장으로 최근 규제 측면에서 여러가지 변화가 감지되고 있으며, 이번 FDA와 CMS의 동시 허가와 급여 등재는 새로운 변화의 시작으로 감지되고 있는 것이다.
아울러 이번 FDA와 CMS의 병행 검토 제도(Parallel Review Prgoram)에 의해 미국의 경우 지난 2011년 10월부터 FDA와 CMS의 동시검토 제도를 수행하고 있으며, CMS의 보험급여 적용 심사를 비정기적으로 시행해왔고, 업체의 요청에 따라 검토해왔다.
이외에도 미국은 2017년 7월 Digital Health Innovation Action Plan을 발표했으며, 이는 의료기기 승인 시 개별 제품이 아니라 개별 기업에 대한 심사를 하겠다는 것으로 즉, Pre-Cert를 인정받은 기업의 경우 출시전 인허가 과정을 면제 받거나 간소화된 인허가 과정을 거치게 돼 있다.
현재 미국에서는 9개 기업을 선정, Pilot Test를 진행할 예정인 가운데 FDA는 지난 11월부터 유전적 건강 위험도 검사(Genetic Health Risk Tests)에 대해서도 Pre-Cert제도를 도입하고 있다.
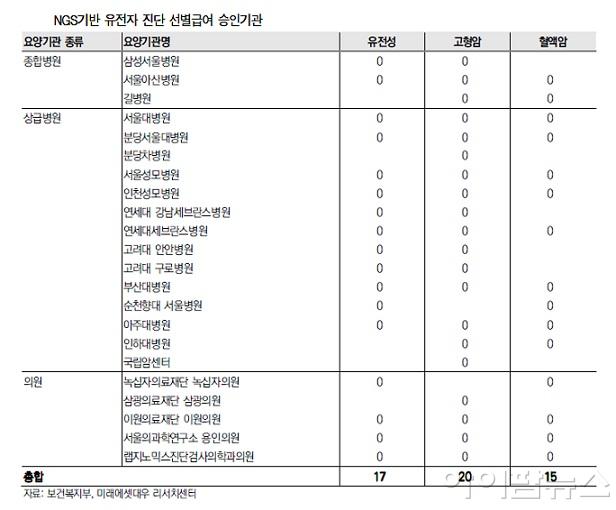
반면 국내에서는 신 의료기기 개발에 있어 규제(포지티브) 리스크가 크게 작용하고 있으며, 의료기기 사업은 허용된 항목 외에는 모두 불법으로 규정되고 있어 외국에서 합법적인 서비스도 불가한 경우가 많고. 희귀유전질환 진단이 여기에 해당되며, ‘F1CDx’와 같은 암유전자 패널 검사도 지난 3월 선별 급여 항목이 신설됐으나 수행기관을 22개 기관으로 한정하고 있다.
또 기존의 없던 새로운 의료기기의 경우 식약처의 의료기기 인증심사 이후 신의료 기술평가를 받아야 하며, 통과하지 못하면 의료기기로 인증을 받고서도 수가가 인정되지 않아 사실상 판매 자체를 못하게 되고, 국내의 수술로봇 업체들과 루트로닉의 망막병증 치료기의 경우가 여기에 해당 된다는 것이다.
국내에서 ‘F1CDx’와 같은 암유전자 패널 검사는 지난 3월 선별급여 항목으로 신설됐으며, 검사대상자는 고형암 및 혈액암 환자와 유전성 질환자 및 의심환자로 고형암 10종(위암, 폐암, 대장암, 유방암, 난소암, 악성 뇌종양 등), 혈액암 6종(급성 골수성, 림프구성 백혈병 등), 유전 질환 4종(유전성 난청, ·망막색소변성 등)이 포함돼 있다.
그러나 건강보험에서 100% 급여가 아닌 본인부담금 50%(45~66만원 수준)으로 그나마 22개 기관(3개의 진단검사업체 부설 기관 포함)으로 검사기관이 한정돼 있으며, 선정기관은 1년마다 재평가를 받게 되며, 내년 2월 27일까지 기선정된 22개 기관외 다른 곳에서는 비급여로도 NGS기반 유전자패널검사를 실시할 수 없는 실정이다.
최근 국내에서도 4차산업 혁명과 관련, 의료기기 산업의 포지티브 규제에 대한 변화 필요성에 대한 공감대가 형성되고 있는 가운데 최근 변화하고 있는 미국의 전향적인 규제 변화 흐름이 주목되고 있으며, 최근 국내에서 진행되고 있는 ‘문재인 케어’로 인한 급여 적용 항목 확대를 고려할 때 국내 의료기기 산업의 규제 리스크가 향후 축소될 가능성이 높은 것으로 전망되고 있다.
한편 국내 유전체 분석 관련 의료기기 업체로는 마크로젠, 랩지노믹스, 테라젠이텍스, 디엔에이링크 등이 시장 진입을 위해 활동을 강화하고 있으나 규모 면네서 영세성을 탈피하지 못하고 있다.



 위로
위로 목록
목록